2.2.3 - Recueillir les données
CONSEIL
Les inventaires de chiroptères hors grottes ne doivent pas être réalisés par temps de pluie ou à une t° inférieure à 8°C. Les conditions météo favorables sont celles qui permettent aux oiseaux de chanter et qui assurent la visibilité. Les IPA oiseaux sont réalisés dans des contitions de dates, heures et météorologie très contrôlées.
En ce qui concerne les invertébrés, notamment les insectes volants, le climat a une grande influence sur l’observation des individus. Ils sont plus abondants dans des conditions climatiques chaudes.
CONSEIL
L’aide d’un professionnel est souvent nécessaire pour définir le protocole d’échantillonnage. Mais le gestionnaire peut effectuer lui-même les prélèvements donc réaliser les captures ou observations sur le terrain, à condition que le protocole ait été validé avec un spécialiste.
|
2.2.3.1 Vérifier les conditions de réalisation 2.2.3.2. Observer, contacter les espèces, prélever les échantillons |
2.2.3.1 Vérifier les conditions de réalisation
Les comptages sont généralement limités à une saison donnée, une heure et un jour. Pour être interprétables, la plupart des méthodes doivent être effectuées toujours dans les mêmes conditions d’observation tout au long de l’étude : conditions de couvert végétal et météorologiques comparables. Les conditions météorologiques influent sur le comportement des animaux. Par exemple, à mesure que la température s’élève dans la journée, la plupart des insectes deviennent de plus en plus mobiles et rapides et leur capture de plus en plus difficile. Aussi, la plupart des méthodes ne sont pas applicables par temps de pluie ou par grand vent (notamment pour les insectes), ou encore parce qu’il a neigé (trace de mammifères non visibles par exemple). La grande disparité concernant la période d’activité des différentes espèces, ainsi que leur étroite dépendance des conditions météorologiques peuvent rendre difficile l’échantillonnage. Le gestionnaire ne se rendra sur le terrain que si les conditions météorologiques sont favorables aux observations. Ces conditions de réalisation sont précisées pour chaque méthode standardisée.
2.2.3.2. Observer, contacter les espèces, prélever les échantillons
Certaines espèces sont facilement observables, d’autres le sont plus difficilement. Pour les espèces facilement observables (grands mammifères, certains oiseaux, espèces végétales), la collecte des données se fait généralement par la simple observation sur le terrain selon le protocole d’échantillonnage défini (le long d’un tracé ou sur une surface témoin) et à l’aide de la technique de relevé la plus pertinente. Le personnel doit être formé à toutes les méthodes d’échantillonnage et ces méthodes doivent être respectées strictement.
Plus un gestionnaire recueille d’informations sur un problème particulier, meilleure en est sa connaissance. Mais corrélativement, plus il accumule de données, plus il devient difficile de les traiter. Une pléthore d’informations peut donc s’avérer aussi embarrassante dans la compréhension d’un problème qu’une pénurie de données. Comme cela a été défini précédemment, le gestionnaire devra veiller à ne pas recueillir des données inutilisables ou des échantillons qui ne seront pas exploités.
 |
| Photo n°45 : Recueil de données sur la flore dans la RN de François-le-Bail, Ile de Groix. © Photothèque RNF. |
Dans le cas de mesure de paramètres physico-chimiques, le gestionnaire peut être amené à recueillir les échantillons pour un laboratoire qui les analysera. Tous les échantillons doivent être étiquetés et accompagnés des informations suivantes : date, lieu, noms des personnes responsables, méthode de prélèvement, matériel utilisé, moyens de stockage et de transport, et tout changement ayant lieu dans les méthodes, ainsi que des autres données spécifiques à l’étude (température, heure de la journée, vitesse du vent, par exemple).
Le gestionnaire peut être amené, au cours de la même année d’observation, à visiter plusieurs fois les mêmes échantillons (transects, points contacts...) rendant la période d’observation plus ou moins étalée dans le temps. L’ordre de la visite doit être désigné de telle sorte que la saison de la visite, d’une année à l’autre, reste la même pour chaque échantillon. Par exemple si on a dix transects à visiter, on commencera toujours de 1 à 10 et non de 10 à 1, car les conditions d’enregistrements peuvent varier dans le temps qui s’écoule entre l’enregistrement du transect 1 et celui du transect 10.
2.2.3.3. Localiser les observations sur une carte
Sur le terrain, la personne qui collecte les données se doit de localiser les observations sur une carte ou noter le lieu exact sur la fiche de relevés standardisée (voir page 63). Une observation est localisée sur une carte à l’aide d’un point au minimum, mais d’autres signes peuvent être utilisés pour la «caractériser». Par exemple dans la méthode de cartographie des territoires d’oiseaux, chaque oiseau vu ou entendu, est figuré par un signe particulier.
Niveau de précision
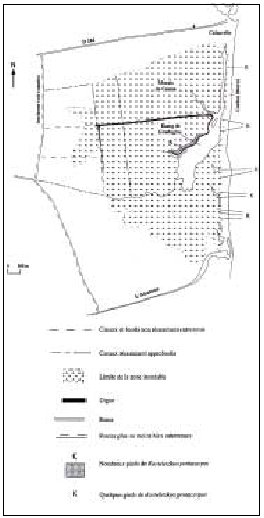 |
| Figure n°46 : Localisation des stations de Kosteletzkya pentacarpos dans un étang de la RN de Biguglia. Source : RAVETTO et al., 1997. |
Il peut s’agir d’une localisation exacte (point recueilli à l’aide d’un GPS ou point précis le long d’un transect) ou correspondant à un secteur ou un maillage (voir Figures n°46 et n°47). Les données peuvent être collectées en localisant les informations sur une grille surimposée à un support pertinent par rapport à l’échelle de travail et la taille de l’espace naturel. Par exemple, dans les réserves naturelles périphériques au Parc National des Ecrins, la localisation des données se fait suivant un système géographique en grades.
La localisation des données est rapportée à une maille qui est à l’échelle de 1 centigrade (cgr), 0,5 cgr ou 0,25 cgr. La localisation des points d’observation est fournie par les coordonnées x et y de l’angle inférieur gauche de la maille de 1 cgr, de 0,5 cgr suivant le degré de précision de localisation. Dans la Réserve Naturelle de Nohèdes (Pyrénées orientales) une grille est surimposée à la photographie aérienne couleur. Ce système de grille permet de préparer une série de cartes qui souvent font apparaître des relations intéressantes entre les variables suivies (voir Figure n°47).
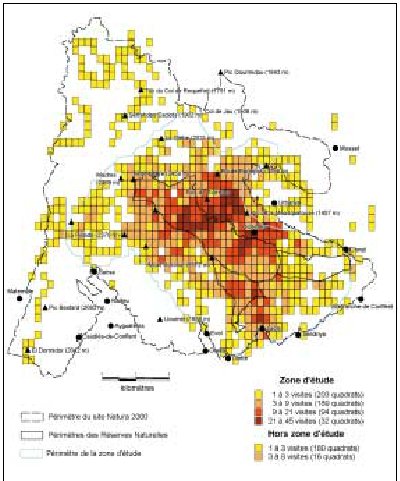 |
| Figure n°47 : Localisation de la pression des inventaires dans la RN de Nohèdes (Pyrénées-Orientales) |
Pour connaître avec précision la position de toute espèce contactée sur le terrain, il peut être utile, si la carte souhaitée n’existe pas, d’établir un plan du terrain le plus précis possible (généralement réalisé au début du plan de gestion pour une réserve naturelle). Ceci est valable aussi pour le choix des stations d’échantillonnage. Les cartes de bases habituellement requises pour localiser les informations écologiques, comme la distribution des espèces végétales ou animales, sont les cartes IGN TOP 25 au 1/25000ème, celles de la réserve naturelle ou autres cartes réalisées dans le cadre du plan de gestion, ou encore des photographies aériennes. Sur ces supports le gestionnaire aura pris soin de localiser auparavant les placettes échantillons. Dans la RN de la Dune Marchand (Nord), la localisation se fait sur une carte au 1/2000ème numérisée sur un SIG grâce à des orthophotoplans réalisés sur la base de photographies aériennes. Les infrarouges sont également utilisés. Sur le terrain, l’observateur pourra noter les contacts qu’il a eus avec les espèces sur la photographie aérienne (ou calque sur la photo).
Utilisation de cartes et de photographies aériennes
 |
| Photo n°46 : Photographie aérienne de la RN des Sept-Iles réalisée à partir d’un ULM. En blanc, la zone où nichent les fous de Bassan. © J.-M. CATON / ENVERGURE |
Les photographies aériennes sont particulièrement utiles pour le programme de suivi écologique. Il se peut, dans certains cas, qu’une photographie aérienne soit suffisante pour repérer les observations ou les échantillons. Des séquences de photos verticales peuvent être assemblées en mosaïque. Elles contiennent plus de détails que les cartes standard (IGN) et rendent plus facile l’identification des éléments du patrimoine (CLARKE, 1986). Le gestionnaire peut également commander une série de photographies aériennes réalisées à basse altitude à l’aide d’ULM (voir Photo n°46). Attention : la simple reproduction ou transcription de la photographie aérienne intègre les déformations car les photos prises en altitude sont toujours légèrement obliques sur les bords. Il y a donc un intérêt à réaliser des corrections informatiques en utilisant un couple de photos pour la stéréoscopie et en réalisant les corrections avec des orthophotoplans (vue rigoureusement verticale).
Limites
 |
| Photo n°47 : Traces de pas d’oiseaux dans la RN du Val de Loire. © A. CHIFFAUT. Les indices de présence comme les traces renseignent sur la fréquentation d’une espèce sur le site mais ne donnent pas d’informations précises sur l’utilisation de cet espace. |
Certaines méthodes d’observation ou de capture permettent une localisation assez précise des espèces, correspondant alors à la localisation des stations ou des pièges ou du point d’échantillonnage (grotte pour une chauve-souris, source d’un cours d’eau pour une mesure physico-chimique).
Par contre certains indices de présence ne sont pas des indicateurs fiables de la localisation (les plumes,…). L’utilisation des pelotes de rejection rencontre certaines limites quant à la localisation précise de l’habitat de la proie consommée par un rapace. En effet, la présence de la proie dans une pelote dépend du rayon de chasse du prédateur, du milieu qu’il utilise ainsi que des préférences de son régime alimentaire.
2.2.3.4. Conserver les échantillons
Précautions
Il se peut que certaines mesures de paramètres nécessitent la collecte de données sur le terrain pour une analyse en laboratoire. Dans ce cas, un certain nombre de précautions doivent être suivies pour conserver les échantillons. ll faut convenir avec le spécialiste de la manière dont il souhaite récupérer le «matériel». Pour certaines espèces, il faut traiter rapidement les échantillons et les conserver dans l’alcool. Dans le cadre d’une étude expérimentale à la RN de la Truchère (voir aussi page 18), les tétards sont récupérés et conservés dans l’alcool en vue d’une étude des stades larvaires en laboratoire. Si un paramètre physico-chimique n’est pas mesuré in situ (sur l’eau par exemple), pour éviter les interférences, il est nécessaire de respecter les éléments suivants :
- Le temps entre le prélèvement et l’analyse doit être le plus court possible.
- Il faut conserver les échantillons au frais et à l’abri de la lumière. Si l’échantillon ne peut pas être analysé rapidement, respecter les méthodes de conservation.
- Il faudra veiller à respecter la nature du flacon, qui dépend des substances analysées.
Collection de référence
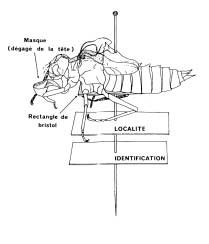 |
| Figure n°48 : Pour intégrer une collection de référence, l’exuvie d’odonate est montée sur une épingle entomologique (DOMMANGET, 1981). |
Pour ce qui concerne les insectes, les collections de référence sont importantes pour des confirmations ultérieures et pour permettre d’ajuster les inventaires en fonction des progrès de la systématique (d’après DOMMANGET, 2000). Une espèce d’insecte échantillonnée difficile à reconnaître doit être présente dans une collection de référence. Attention, une collection de référence ne se réalise pas n’importe comment et doit répondre à un objectif de conservation. Pour obtenir des informations sur sa réalisation, il est conseillé de contacter l’OPIE (Office pour les insectes et leur environnement, basé à Guyancourt).
La photographie peut constituer une technique complémentaire indispensable pour la détermination et la «conservation» des espèces d’invertébrés, notamment pour fixer les couleurs, les comportements ou attitudes, mais elle ne remplace pas la collection de référence (DOMMANGET J.-L. et al., à paraître). La photographie est aussi utilisée pour reconnaître les individus d’espèces qui présentent des marques distinctives morphologiques donnant lieu à de véritables cartes d’identité (Sonneur à ventre jaune, phoques, mérous…)

