1.3.7 - Définir les modalités de l’échantillonnage
CONSEIL
Certaines méthodes, de capture notamment, peuvent affecter la faune ou la flore.
Le gestionnaire devra veiller à ce que le nombre d’échantillons soit non destructeur (et/ou non perturbant). Une ligne de pièges à Coléoptères type «Barber» constituée par exemple d’un piège tous les 10 m sur un transect de 100 m peut être à long terme terriblement ravageur, ce qui est à proscrire sur une réserve naturelle (EMERIT, non daté).
CONSEIL
Certains modes d’échantillonnage entraînent un appauvrissement de la population étudiée. Lors d’un suivi à long terme, d’insectes par exemple, sur des stations limitées en nombre, éviter des prélèvements répétés aux mêmes endroits.
CONSEIL
Chaque point IPA doit faire l’objet d’au moins deux dénombrements, l’un au début du printemps avant fin avril, l’autre en fin de printemps avant fin juin. La première visite permet de contacter d’abord les nicheurs précoces, la seconde les migrateurs ou nicheurs tardifs.
 L’échantillonnage est fondamental et résulte de l’impossibilité de collecter des données sur tous les éléments d’une population ou d’une surface, souvent pour des raisons pratiques, techniques ou économiques.
L’échantillonnage est fondamental et résulte de l’impossibilité de collecter des données sur tous les éléments d’une population ou d’une surface, souvent pour des raisons pratiques, techniques ou économiques.
L’échantillonnage permet alors d’étudier le tout par le biais des statistiques. Il est pourtant d’après SCHERRER (1984), l’un des aspects les plus négligés de la biostatistique, c’est ce qu’on peut constater aussi dans les espaces naturels.
La partie de la population que l’on va examiner s’appelle l’échantillon. Définir les modalités de l’échantillonnage consiste à définir la localisation, le nombre et la taille des échantillons de la population statistique.
Le recours à un spécialiste est souvent nécessaire pour aider le gestionnaire à définir la localisation et la densité des échantillons, la périodicité et la durée de l’échantillonnage. Il faut également se soumettre aux contraintes budgétaires et trouver un échantillon optimal pour baisser le coût des collectes et augmenter la précision des résultats.
1.3.7.1. Choisir le plan d’échantillonnage
 |
| Photo n°28 : Récolte d’échantillons dans la RN de Müllembourg. © G. BENTZ. |
Choisir le plan d’échantillonnage consiste à choisir de quelle manière les données seront recueillies sur le terrain (en certains endroits choisis au hasard, dans tous les habitats fréquentés par l’espèce visée…) donc choisir une méthode pour localiser les échantillons. Il conditionne aussi le mode de traitement des données et donc les résultats. Les modalités de l’échantillonnage sont souvent déjà incluses dans les protocoles standards. Par exemple : écouter les oiseaux en parcourant un transect de 3 km à vitesse constante avec la méthode des IKA.
Selon le but visé et les contraintes rencontrées, plusieurs plans d’échantillonnage sont disponibles et répondent à des besoins particuliers. Les trois principaux types sont l’échantillonnage aléatoire simple (au hasard), l’échantillonnage systématique et

l’échantillonnage stratifié (GOLDSMITH, 1991). Mais il en existe d’autres : à probabilités inégales de sélection des unités, subjectif, mixte et par degré, que l’on ne détaillera pas ici.
Echantillonnage au hasard
 |
| Figure n°15 : Echantillonnage au hasard. |
L’échantillonnage aléatoire simple est une méthode qui consiste à prélever au hasard et de façon indépendante «n» unités d’échantillonnage d’une population de «N» éléments (voir Figure n°15). Les échantillons sont répartis au hasard. Chaque point dans l’espace étudié a donc une chance égale d’être échantillonné. Les données ainsi récoltées ne sont pas biaisées. A partir d’une carte ou d’une photographie aérienne, l’oeil humain ne sait pas choisir les échantillons. Une pratique largement utilisée consiste à utiliser une grille pour les choisir de manière plus aisée. Une méthode garantissant sécurité et représentativité consiste à dresser la liste complète et sans répétition des éléments de la population, à les numéroter, puis à tirer au sort «n» d’entre eux à l’aide d’une table de nombres aléatoires ou de tout autre système générant des chiffres aléatoires. Chaque élément sélectionné peut être remis dans la population après son tirage pour éventuellement être choisi une deuxième fois : on parle alors d’échantillonnage avec remise. Cette méthode se prête aux analyses statistiques, mais elle demande de prélever un grand nombre d’échantillons.
Echantillonnage systématique (Figure n°16)
 |
| Figure n°16 : Echantillonnage systématique |
Ce type d’échantillonnage consiste à répartir les échantillons de manière régulière (tous les «x» mètres par exemple). Il est moins demandeur en temps qu’un échantillonnage aléatoire. On utilise habituellement un quadrillage (souvent positionné sur la photographie aérienne du territoire étudié). Les points d’échantillonnage sont ainsi faciles à localiser à chaque relevé, c’est un avantage considérable dans le cadre d’un suivi permanent. Si les espèces nichent au même endroit tous les ans, le comptage devient plus facile avec le temps. Le gestionnaire réalise aussi un échantillonnage systématique lorsqu’il privilégie les inventaires dans les secteurs les plus susceptibles d’abriter les espèces (habitats potentiels). Il porte alors une plus grande attention aux milieux répondant à leurs exigences écologiques. L’étude des orthoptères et des coléoptères coprophages de la RN de Prats-de-Mollo repose par exemple sur l’échantillonnage systématique des principaux biotopes (PUISSANT et al., 1998). Il peut s’agir d’une aire de nidification (gîtes, colonies de reproduction…), d’une zone de repos (dortoirs) ou de nourrissage des oiseaux, d’une zone d’hibernation ou d’estivage des chauves-souris. Par exemple, pour les chauves-souris, le gestionnaire cherchera en priorité dans les grottes mais aussi les galeries, mines, bâtiments, ponts, tunnels, arbres creux (voir Figure n°17). La recherche des amphibiens nécessite de prospecter deux milieux. Ils exploitent en effet des habitats terrestres (sites d’hivernage ou de vie durant l’été) et aquatiques (sites de reproduction). Pour certaines espèces il faut prospecter le long des cours d’eau ou près des lacs pour la capture au filet.
En termes de résultats, une recherche systématique par secteur fournit des cartes d’occupation des territoires par espèce.
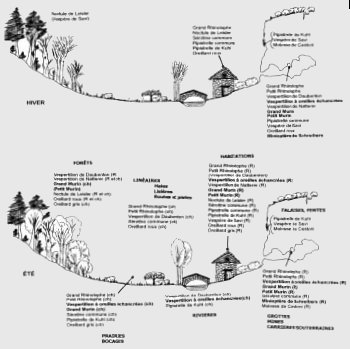 |
Figure n°17 : Fréquentation théorique de différents habitats par les chiroptères signalés dans le massif Madres Coronat Source : LETSCHER, 2001 d’après Hercent, 1997 ; Schober et |
Le positionnement des pièges pour les espèces difficilement observables (invertébrés ou encore mammifères) est souvent fait de manière systématique sur un secteur donné ou le long de gradients. La figure n°18 nous montre comment sont localisés et répartis les pièges de micromammifères le long d’un transect dans une réserve naturelle.
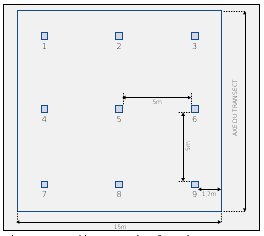 |
Figure n°18 : Positionnement des pièges de micromammifères le long d’un transect dans la RN du Platier d’Oye. |
Echantillonnage stratifié (Figure n°19)
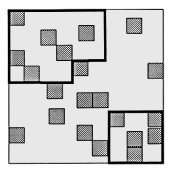 |
| Figure n°19 : Echantillonnage stratifié |
Il est particulièrement utilisé quand l’aire étudiée est divisée en zones différenciées. Les strates peuvent correspondre à des divisions administratives, des unités de gestion, à des zones à topographie ou accessibilité différente... Il consiste à subdiviser une population hétérogène en sous-populations ou strates plus homogènes. La stratification s’impose lorsque les résultats sont recherchés au niveau de chacune des souspopulations.
Le gestionnaire répartit alors les échantillons au sein des strates (en procédant éventuellement par un échantillonnage au hasard) avec un nombre proportionnel à l’aire de chacune. L’échantillonnage stratifié au hasard inclut les avantages d’un échantillonnage
| Pour évaluer l’importance des populations de grands herbivores, le Parc national des Cévennes a été divisé en 5 strates correspondant aux différents types de végétation. Dans chaque strate, des itinéraires échantillons ont été répartis régulièrement selon les principes de l’échantillonnage systématique. A partir de la superficie de chaque strate et de la surface du couloir, on déduit le nombre de lignes possibles. Figure n°20 : Répartition de l’effort d’échantillonnage par tranche d’altitude dans la RN de Nohèdes. Une technique utilisée par LECOMTE et LE NEVEU (1986) consiste à mettre en place des relevés de type phytosociologique non pas régulièrement tous les « x » mètres, mais à chaque modification du tapis végétal. L’intérêt de cette méthode est qu’elle intègre l’hétérogénéité de la végétation et qu’elle permet de suivre les évolutions spatiales de la végétation au cours du temps. |
systématique (meilleure couverture de l’espace et meilleure exactitude des résultats). Le gestionnaire pourra utiliser toutes les connaissances acquises sur la végétation et le milieu pour découper la zone à étudier en sous-zones plus homogènes qui seront échantillonnées séparément. Un pré-échantillonnage est possible, notamment à l’aide de la cartographie (cartes géologique, géomorphologique, pédologique, topographique (Figure n°20)…, ou de photographies aériennes.
Dans un premier temps, la carte de la végétation réalisée dans le cadre du plan de gestion peut permettre de cibler les secteurs à échantillonner Dans le cas de mosaïque de milieux, il peut être souhaitable de réaliser des relevés à chaque changement de végétation.
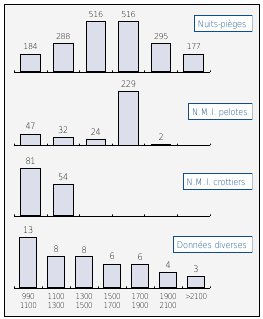 |
Figure n°20 : Répartition de l’effort d’échantillonnage par tranche d’altitude dans la RN de Nohèdes. Source : LETSCHER, 1998. |
Autres modes d’échantillonnage
- L’ÉCHANTILLONNAGE SUBJECTIF est la forme la plus simple et la plus intuitive d’échantillonnage. L’observateur juge les emplacements représentatifs des conditions du milieu et choisit comme échantillons les zones qui lui paraissent particulièrement homogènes et représentatives d’après son expérience. Cette façon de procéder, très dépendante de la représentation conceptuelle d’un habitat (conforme à l’image de l’habitat typique par exemple), de la perception du milieu donné et de l’itinéraire de l’observateur, n’a rien d’aléatoire ni par conséquent, de représentatif. Ce type de méthode est donc à éviter.
- Les études bibliographiques montrent que l’on peut combiner plusieurs types d’échantillonnages pour les adapter à leur situation sur le terrain. On parle alors d’ÉCHANTILLONNAGE MIXTE.
- Il existe aussi une méthode dite d’ÉCHANTILLONNAGE À CHOIX RAISONNÉ. Par exemple pour l’étude d’un lac, les prélèvements seraient au niveau de l’endroit le plus profond. Malgré la puissance des techniques d’analyses multidimentionnelles, cette stratégie d’échantillonnage possède de sérieuses limites.
- Il existe aussi l’échantillonnage au jugé ou encore par degré (en grappe)…
|
Quel type d’échantillonnage choisir ? La plus grande rigueur appelle un ÉCHANTILLONNAGE ALÉATOIRE, particulièrement un échantillonnage au hasard qui fournit un échantillon représentatif de la population statistique, dont les données seront plus faciles à analyser, et s’avère être l’instrument par excellence de l’approche descriptive (voir chapitre A.3.2. pages 26 et 27). Si l’aire d’étude est trop grande, on choisira de travailler sur des unités échantillonnées au hasard, la donnée sera extrapolée à l’aire totale de l’étude. Dans plusieurs cas cependant, les exigences de coût et de temps disponibles et de moyens humains peuvent rendre un ÉCHANTILLONNAGE SYSTÉMATIQUE de meilleur rapport qualité-prix. Généralement, un plan d’échantillonnage systématique donne le maximum de résultats. Plus rapide à utiliser, il est intéressant, mais il faut bien choisir le maillage (l’intervalle entre les échantillons). Dans le cas d’une étude de la végétation, le point de départ et la direction du transect peuvent être localisés au hasard, mais les échantillons individuels le long d’un transect disposés systématiquement. L’ÉCHANTILLONNAGE STRATIFIÉ permet aussi de gagner du temps car les moyens disponibles ne permettent pas toujours de réaliser un inventaire sur l’ensemble ou un maximum des faciès de la végétation de l’espace naturel. |
1.3.7.2. Définir le nombre d’échantillons
 Le nombre d’échantillons peut être défini dans le temps et dans l’espace :
Le nombre d’échantillons peut être défini dans le temps et dans l’espace :
- des relevés peu fréquents (annuels par exemple) mais sur un nombre important de placettes,
- un certain nombre de relevés réguliers (un par semaine par exemple) sur peu de stations.
Dans tous les cas, le nombre et la répartition des stations à observer doivent être fixés dans le cadre d’un plan d’échantillonnage.
Tenir compte de la représentativité
La représentativité constitue la première qualité que doit posséder un échantillon. Pour que les résultats soient généralisables à la population statistique, l’échantillon doit être représentatif de cette dernière, c’est-à-dire qu’il doit refléter fidèlement sa composition et sa complexité et fournir une estimation précise et non biaisée des paramètres mesurés sur les objets dans une aire donnée, à un moment donné. C’est l’une des difficultés majeures de l’échantillonnage en écologie. En effet, pour beaucoup, un échantillon est représentatif lorsque le nombre d’espèces le composant n’augmente pratiquement plus avec un accroissement de l’effort d’échantillonnage (cas des aires minimales pour les habitats (voir page 43). Ce critère empirique n’a pas grande valeur selon GOUNOT (1987), puisque la présence, dans un échantillon, de la quasi-totalité des espèces du milieu ne garantit aucunement la justesse de l’estimation de leur abondance. Le gestionnaire, éventuellement avec l’aide d’un spécialiste, doit trouver le nombre d’échantillons suffisants pour que cela soit représentatif de l’ensemble. La description d’un peuplement d’oiseaux doit, par exemple, compter un effectif d’IPA suffisamment important pour représenter la majeure partie des espèces et exprimer les abondances avec une certaine fiabilité, exprimée en particulier par un intervalle de confiance.
Tenir compte de la fiabilité et de la précision
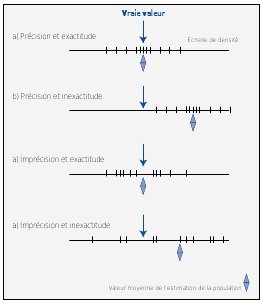 |
| Figure n°21 : Notions de précision et d’exactitude. Source : BIBBY et al., 1992. |
Les résultats d’une étude sont d’autant plus fiables que le nombre de données à traiter est important. Ce dernier dépend de l’intensité des prélèvements, donc du nombre d’échantillons.
Plus le nombre d’échantillons est important, plus les résultats seront fidèles à la réalité, plus la valeur estimée s’approche de la valeur réelle. Le résultat devient plus précis (voir Figure n°21). Si le nombre d’échantillons est insuffisant, dans le domaine des analyses de pollution par exemple, on peut être amené à déclarer qu'il n'y a pas d'impact alors que l'on n'a pas la quantité d’échantillons nécessaire pour certifier ce «non impact» (SHEPPARD, 1999). Vouloir augmenter la précision prend plus de temps. En effet, l’amélioration de la précision n’est pas proportionnelle à l’effectif de l’échantillon mais à sa racine carrée. Ainsi, quand «n» devient grand, il faut de fortes augmentations de l’effectif pour obtenir un accroissement substantiel de la précision. Par exemple, pour doubler la précision obtenue à partir de 10 échantillons cela nécessite d’en prendre 30 nouveaux. Pour la doubler à nouveau, il faudra en prendre 120 autres. Cela devient rapidement irréaliste ! La valeur de la précision doit donc être corrélée avec le temps disponible et les objectifs. Sur une aire fixe de petite taille, la question de la précision n’est pas la même. L’étude peut être réalisée sur l’ensemble du terrain. Mais le résultat ne peut pas être généralisé et appliqué ailleurs.
Prendre en compte la taille des unités d’échantillonnage et du site
Plus les unités d’échantillonnage sont petites, plus elles doivent être nombreuses (voir aussi chapitre 1.3.3), pour les habitats notamment.
Quand la possibilité est offerte, il vaut mieux définir des éléments de petite taille et constituer un échantillon de grande taille que l’inverse. De plus, plus la
taille est petite moins le gestionnaire aura de temps à passer par échantillon. Cela permet, par exemple, d’utiliser davantage de quadrats pour une étude de
la végétation, ce qui augmente l’exactitude des estimations (GOLDSMITH, 1991).
Le nombre d’échantillons dépendra de la taille du site, de leurs nature, hétérogénéité et diversité ou de la population statistique.
|
Si par exemple on peut faire sans risque quelques prélèvements de 0,25 m2 dans la Réserve Naturelle de Nohèdes (Pyrénées orientales) qui fait plus de 2 000 ha, il faut être très prudent quand il s’agit d’opérer sur la végétation des pelouses à Isoetes de la Réserve Naturelle de Roque-Haute car elles contiennent trois plantes rares qui ne couvrent chacune que quelques dizaines de m2. |
Tenir compte des recommandations des méthodes standardisées
Dans les méthodes standardisées (voir chapitre A.3.6.2. page 34) le nombre exact d’échantillons nécessaires n’est généralement pas précisé, car celui-ci peut varier d’un site à l’autre, mais des indications sont données au gestionnaire. Avec la méthode des plans quadrillés (cartographie des territoires d’oiseaux), le nombre et la durée des visites ne sont ni définis, ni limités. Ils doivent être assez importantes pour que l’observateur atteigne, à la fin du printemps, une connaissance quasi exhaustive du peuplement d’oiseaux ayant niché sur le quadrat. Avec cette méthode, un test fait sur l’espèce la moins bien représentée permet d’évaluer le nombre de visites nécessaires. Toutefois, il est recommandé de réaliser un nombre minimum de 8 visites en milieu ouvert et de 10 en milieu fermé.
| Avec la méthode des IPA (oiseaux) il n’y a pas un nombre de points idéal, mais l’expérience montre qu’il faudra au moins une douzaine d’IPA pour représenter correctement un milieu homogène. Il en faut davantage si l’on recherche une plus grande précision ou pour étudier des milieux complexes. Dans le cadre du suivi des roselières dans les réserves naturelles, le nombre d’échantillons nécessaire à une étude statistique a été fixé à 50. |
Tenir compte des besoins pour l’analyse et l’interprétation des données
Le nombre d’échantillons doit être suffisamment élevé pour une analyse statistique pertinente des résultats. Classiquement, le nombre d’échantillons minimum proposé est de 30, par exemple pour des analyses factorielles (voir page 81). Cependant, les statistiques non paramétriques (voir page 85) permettent de travailler avec un nombre d’échantillons plus faible.
Il n’est pas évident de démontrer (statistiquement) des changements significatifs dans le temps pour des espèces qui ont une fréquence faible dans les relevés (FROM et al., 1997). Pourtant si on veut montrer des variations il est important que ces variations apparaissent entre les échantillons. Le gestionnaire définira un nombre d’échantillons suffisant pour mettre en évidence les changements dans le temps ou dans l’espace, par exemple un gradient entre les différents types de végétation étudiés le long d’un transect (voir Figure n°22). Si les densités de population sont basses, le nombre d’individus détectés lors d’un comptage est faible. Afin d’obtenir un jeu de données plus conséquent, il est nécessaire de procéder à une répétition des comptages sur chacun des sites de prospection.
Utiliser les résultats des inventaires
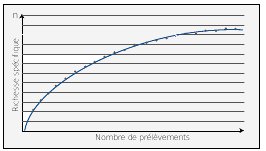 |
| Figure n°23 : Évolution théorique de la richesse spécifique estimée d’une station à partir du nombre de prélèvements. |
Un moyen de connaître le nombre d’échantillons est de construire la courbe cumulée de la richesse totale (voir Figure n°23). Les relevés effectués sur le terrain permettent de construire cette courbe en fonction de l’effort d’observation (nombre de relevés). Le rapport - nombre d’espèces présentes dans tous les relevés (E) / nombre de relevés (R) - fait apparaître le nombre théorique de relevés supplémentaires nécessaires pour ajouter une nouvelle espèce à la liste. Par exemple si on obtient 0,1 il faudra effectuer 10 relevés supplémentaires pour obtenir une nouvelle espèce. La richesse cumulée devient alors très proche de la richesse réelle.
Dans la RN des Marais de Müllembourg, la richesse totale de la zone échantillonnée représentative des milieux rencontrés est de 26 espèces. L’asymptote de la courbe cumulée montre que c’est au terme des 6 premiers quadrats que le gestionnaire connaît, avec suffisamment de précision, la composition qualitative du peuplement. Le rapport E/R montre qu’il aurait fallu 6 relevés supplémentaires pour ajouter une nouvelle espèce à la liste (avec E = nombre d’espèces de fréquence 1 et R = nombre total de relevés).
1.3.7.3. Définir la taille des unités d’échantillonnage
Les unités d’échantillonnage ont été définies dans le chapitre 1.3.3. La taille des échantillons ne pose pas de problème lorsqu’il s’agit d’une espèce. Elle est plus problématique quand on a affaire à une communauté végétale puisque cela nécessite généralement de délimiter des quadrats.
Un choix dépendant du mode de répartition de l’objet.
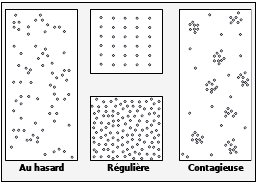 |
| Figure n°24 : Les différents modes de répartition spatiale des individus, a) au hasard, b) régulière et c) contagieuse. Source : ELLIOTT, 1971 in FAGOT, 2000. |
La surface d’échantillonnage va dépendre avant tout du mode de répartition de la variable étudiée, qui peut, dans le cas d’une espèce, être divisée en trois
cas (voir Figure n°24) :
- répartition au hasard,
- répartition régulière,
- répartition contagieuse.
Le gestionnaire choisira la surface qui minimisera les fluctuations d’échantillonnage. Dans le cas d’une répartition contagieuse, par exemple, le quadrat doit englober, au moins en partie, un groupe d’individus. La taille du quadrat doit être définie pour que la plupart d’entre eux incluent un ou plusieurs des individus à plus large répartition.
Un choix dépendant du nombre et de la fréquence des espèces présentes
C’est en fait le principe de la courbe de biodiversité qui est utilisée pour déterminer la taille des placettes à échantillonner, au cours de la première année de suivi (définition de l’aire minimale). L’aire minimale (voir Figure n°26) peut être définie comme la plus petite surface qui rende compte d’une association végétale. Pour la définir le gestionnaire réalisera des relevés de surface de plus en plus grande jusqu’à ce que le nombre d’espèces n’augmente plus (augmentation progressive (voir Figure n°25) ou en hélice (Figure n°26).
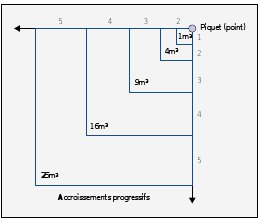 |
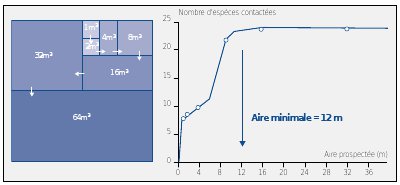 |
| Figure n°25 : Technique de détermination de l’aire minimale (FAURIE et al., 1998) | Figure n°26 : Détermination de l’aire minimale dans la RN de la Tourbière de Venec. |
 La taille d’un quadrat peut être recherchée à partir des fréquences des espèces dans celui-ci. Idéalement la plupart de ces espèces doit avoir une fréquence de 20-70 % sur l’ensemble des relevés. Si une ou plusieurs ont des valeurs de 100 %, la taille du quadrat est probablement trop grande. A l’inverse, si un nombre important de quadrats a une fréquence très faible en espèces, cela signifie que la taille du quadrat doit être augmentée.
La taille d’un quadrat peut être recherchée à partir des fréquences des espèces dans celui-ci. Idéalement la plupart de ces espèces doit avoir une fréquence de 20-70 % sur l’ensemble des relevés. Si une ou plusieurs ont des valeurs de 100 %, la taille du quadrat est probablement trop grande. A l’inverse, si un nombre important de quadrats a une fréquence très faible en espèces, cela signifie que la taille du quadrat doit être augmentée.
La taille de l’unité d’échantillonnage peut être mise en relation avec la variation du nombre d’individus enregistrés entre deux comptages consécutifs. Cette variation devrait, si possible, suivre la règle des 95 % d’intervalle de confiance. Si des variations inacceptables sont trouvées, il faut alors étendre l’aire d’échantillonnage jusqu’à ce que le nombre d’individus comptés se stabilise et que la variation soit réduite au niveau le plus bas (DAVIS, 1982).
Conditions affectant le choix
 |
| Photo n°30 : S’il s’agit de suivre une opération de gestion, comme l’étrépage dans la RN de la Tourbière de Venec, la taille du quadrat suivi est celle de la parcelle étrépée. © D. PESQUER / SEPNB. |
Il se peut que les surfaces soient définies par la méthode de relevé.
Par exemple, en ce qui concerne la méthode des plans quadrillés (cartographie des territoires pour les oiseaux), la superficie de la zone d’étude doit être un biotope (le plus homogène possible) considéré comme représentatif d’une zone bien plus vaste par la suite. On choisit de petites parcelles (10 à 30 ha en général) lorsque l’on travaille sur de petites espèces d’oiseaux ou bien en milieu forestier, et des grandes parcelles (50 à 200 ha ou 40 à 100 ha selon les références bibliographiques) pour les espèces à vastes territoires ou dans un milieu ouvert.
D’après FRONTIER (1982), contrairement à une croyance assez répandue, la taille de l’échantillon n’affecte pas la représentativité, car elle ne fait que varier l’intervalle dans lequel la vraie valeur d’un paramètre de la population a de fortes chances de se trouver. Cependant, pour des études comparatives, il est impératif de standardiser la taille et la forme des échantillons La taille des quadrats pour l’analyse de la végétation doit en principe être la plus petite possible pour limiter le temps à y passer, mais pas trop car sinon le nombre de contacts avec les espèces végétales sera trop faible. Souvent un carré de 1 m2 est utilisé en milieu ouvert. Des carrés plus petits sont utilisés pour des micro-habitats, comme les mousses ou des habitats monospécifiques comme les roselières (la taille du quadrat peut alors être de 25 x 25 cm). Un certain allègement de la méthode consiste à réduire la liste des espèces recensées, dans un quadrat par exemple, ce qui permet d’optimiser sa taille et aussi les dates des visites de terrain (à condition de bien choisir les espèces retenues).
1.3.7.4. Positionner les échantillons
Une fois la taille et le nombre définis, il s’agit de positionner les échantillons (disposition spatiale des pièges dans l’espace par exemple).
 Localisation
Localisation
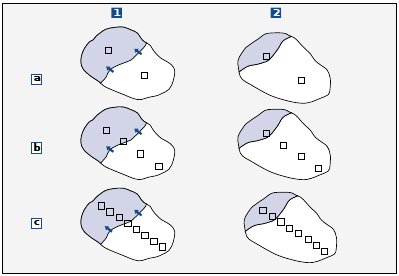
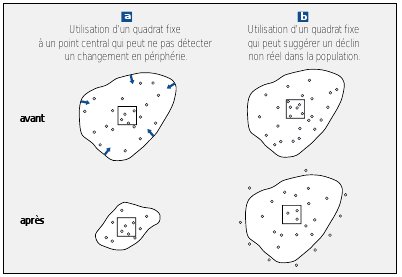
La localisation des échantillons a une très grande importance car elle est peut-être à l’origine d’une interprétation biaisée des résultats (voir Figure n°27).
Les quadrats, généralement représentatifs d’une mosaïque de communautés végétales, semblent être inappropriés si on s’attend à détecter des changements dans l’extension de la répartition de ces communautés. La localisation des stations peut être dépendante de la relation observateurméthode. Pour certaines méthodes, comme les IPA par exemple, le même observateur doit utiliser les mêmes points tous les ans. Si l’observateur change, le parcours doit être considéré comme nouveau.
Contraintes liées au contexte
Le choix de la localisation des stations dépend aussi du milieu et des besoins liés à la méthode. Par exemple, le transect à parcourir pour le suivi des Lépidoptère Rhopalocères dans les réserves naturelles (par la méthode adaptée du Butterfly monitoring, POLLARD et al., 1993), doit traverser les
principaux milieux du site étudié (voir Figure n°29). De la même façon, les IKA doivent être positionnés dans des secteurs homogènes. Le suivi de la qualité de l’eau dans la RN des Marais de Bruges (Aquitaine) est effectué par le Cemagref sur des stations choisies de manière à recouvrir l’ensemble de la réserve et en tenant compte des résultats obtenus en 1996.
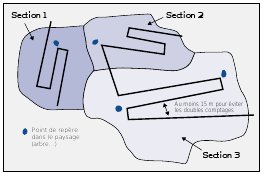 |
Figure n° 29 : Localisation du transect avec la méthode du Butterfly Monitoring Source : POLLARD et YATES, 1993. |
1.3.7.5. Définir la période des relevés
La période est avant tout fonction de l’objet étudié et, s’il s’agit d’une espèce, de sa phénologie. Pour la grande majorité des espèces, le prélèvement des échantillons peut se faire au cours d’une grande période de l’année.
En fonction du groupe étudié
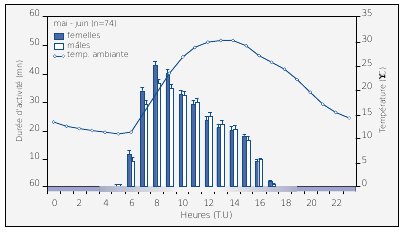
Au cours d’une année, on choisira la période de plus grande activité des animaux correspondant généralement à la période de reproduction, le début du printemps pour la plupart des espèces, juillet ou la première quinzaine d’août pour les chiroptères, à partir de février pour les amphibiens dans la RN de Roque-Haute, au sud de la France (voir Figure n°30). Cette période de forte activité des animaux se manifeste par le chant ou certains comportements.
Il s’agit par exemple de la période de présence des poules de tétras sur les places de chant. Au printemps, les reptiles s’exposent davantage au soleil car leurs besoins thermiques après l’hibernation sont importants. La probabilité de trouver des reptiles sous les pièges est d’ailleurs inversement proportionnelle à leur activité (voir Figure n°31).
 En fonction de la phénologie de l’espèce sur le site étudié
En fonction de la phénologie de l’espèce sur le site étudié
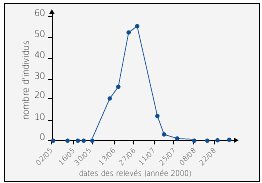 |
| Figure n°32 : Exemple de relevé dans la RN de l’Ile de la Platière : individus comptabilisés de Melanargia galathea en 2000. |
La première année, la période peut être fixée à l’aide de la courbe des observations. C’est pourquoi, tout suivi ne peut être engagé sans avoir validé des inventaires au préalable. Elle est essentielle à connaître pour évaluer la période de recueil des données et les résultats. A la fin de la période de vol d’une espèce de papillon par exemple, une série de comptages est obtenue pour chaque section et transect. Durant la période de vol d’une génération, le nombre d’individus augmente en première phase (émergence et immigration) pour diminuer ensuite (mort et émigration). On obtient donc un graphique (voir Figure n°32) sur lequel on a le pic de présence, ici le 27 juin. Certaines espèces d’insectes sont bivoltines, c’est-à-dire qu’elles ont deux générations et donc deux périodes de vol, comme par exemple Apatura ilia (voir Figure n°53 page 72).
En fonction du lieu
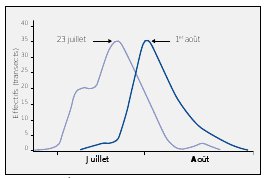 |
| Figure n°33 : Évolution démographique des populations de Maculinea telejus sur les marais de Broues et des Bidonnes en 1998. Source GREFF, 1998. |
Cette phénologie n’est pas identique sur tout le territoire et varie d’une région géographique à l’autre. Il faut donc la rechercher. Cela implique l’établissement d’un calendrier avec le spécialiste concerné. Dans les Pyrénées, la période de présence des poules de Grand Tétras sur les places de chant correspond aux deux dernières décades du mois de mai : à l’est elle est plus précoce qu’à l’ouest, par ailleurs, elle est également fonction de l’altitude. Dans les autres massifs, la période optimale semble être la première décade du mois de mai. L’observateur peut aussi adapter les dates définies dans les méthodes standards au climat régional, les deux dénombrements saisonniers de chaque point IPA par exemple peuvent être décalés de quelques jours, voire de quelques semaines en montagne.
GREFF, (1998), a observé que la période de vol et le pic d’abondance des papillons sont parfois plus tardif d’un marais à l’autre, liés peut-être à la gestion du site (voir Figure n°33). L’explication de ces différences de phénologie de la plante hôte pouvant être liée à une différence de chaleur au sol due à l’ouverture ou non du milieu. La période de vol des papillons semble se caler à la période d’apparition des plantes.
En fonction des objectifs
La période est aussi fonction des objectifs. Pour un même objet, les prospections peuvent avoir lieu en différentes périodes de l’année selon les objectifs visés par le gestionnaire.
| L’inventaire partiel de la Chevêchette d’Europe dans la RN des Hauts-Plateaux du Vercors nécessite des prospections en automne. Les effectifs sont mesurés lors de prospections de printemps. |
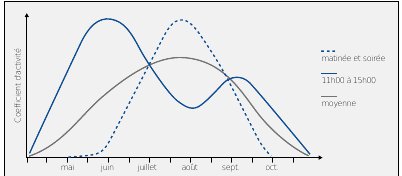
En fonction du moment de la journée
Le moment pour effectuer le relevé dans la période définie est fonction de l’activité territoriale des animaux, en relation avec la période du jour (voir Figure n°34), les conditions météorologiques et les habitats. On observe par exemple les reptiles le matin ou le soir de préférence, au moment où ils ont le plus besoin de chaleur. Certaines méthodes peuvent cependant s’appliquer en dehors des périodes de forte activité (comme la reproduction) : cas des IKA pour les oiseaux par exemple, ou encore du baguage.
 La période la plus propice à l’étude des habitats est évidemment le printemps, lorsque les plantes sont en fleur. Pour la végétation, l’idéal est d’effectuer un relevé par an, toujours au même stade d’avancement de la végétation. Si des méthodes cartographiques à l’aide de photographies aériennes sont utilisées, la période est choisie en fonction de la possible distinction des unités de végétation vues d’en haut. Il sera plus facile de distinguer certains habitats ou certaines essences arborées selon les couleurs des feuilles à l’automne ou des bourgeons au printemps (cas des saules). Pour faciliter le repérage de l’état d’avancement de la végétation, on peut choisir une ou deux espèces indicatrices, de préférence plutôt bien visibles, dont la floraison, par exemple, indiquera le moment auquel il faut faire le relevé.
La période la plus propice à l’étude des habitats est évidemment le printemps, lorsque les plantes sont en fleur. Pour la végétation, l’idéal est d’effectuer un relevé par an, toujours au même stade d’avancement de la végétation. Si des méthodes cartographiques à l’aide de photographies aériennes sont utilisées, la période est choisie en fonction de la possible distinction des unités de végétation vues d’en haut. Il sera plus facile de distinguer certains habitats ou certaines essences arborées selon les couleurs des feuilles à l’automne ou des bourgeons au printemps (cas des saules). Pour faciliter le repérage de l’état d’avancement de la végétation, on peut choisir une ou deux espèces indicatrices, de préférence plutôt bien visibles, dont la floraison, par exemple, indiquera le moment auquel il faut faire le relevé.
Tenir compte des espèces fragiles
La période choisie doit également tenir compte des éventuelles perturbations liées à la présence de l’homme (piétinement, dérangement).
| Il convient d’effectuer les comptages en respectant la phénologie de reproduction des espèces. En règle générale, un recensement durant l’incubation, juste avant les premières éclosions, est la période idéale pour le suivi d’une population d’oiseaux d’eau coloniaux (effectifs maximaux). Mais dans tous les cas, les espèces animales sensibles doivent être dénombrées sans dérangement (cas des colonies de sternes pour la RN du Val de Loire par exemple). Dans cette réserve, la phase d’installation des reproducteurs et la couvaison sont les périodes les plus sensibles, pendant lesquelles tout dérangement doit absolument être évité. Les études porteront sur les adultes en fin d’incubation ou sur des poussins (à partir de fin mai pour les sternes). Certains individus peuvent se reproduire plus tardivement que d’autres. Il faut donc faire les visites de préférence un peu tardives quitte à rater la nidification des individus les plus précoces. C’est préférable à une visite précoce qui pourrait perturber les individus qui ne sont pas encore installés. |
Afin d’éviter tout dérangement des tétras, la méthode
Photo n°31 : La période de couvaison est une période sensible durant laquelle il est préférable de ne pas déranger les animaux. Ici un Grèbe huppé dans son nid. © S. BOUTINOT |
Penser à la fiabilité des résultats
D’après les recommandations de Wetlands International pour le recensement des oiseaux d’eau, plus la période de recensement est restreinte, plus les résultats seront fiables (risques réduits de doubles comptages) et comparables d’une année ou d’un mois à l’autre.
Dans le cas d’un suivi, il est important d’effectuer les sorties toujours à la même période de l’année.
1.3.7.6 Définir la fréquence des relevés
 |
| Photo n°32 : Tortue d’Hermann (Testudo Hermanni). Pour les tortues, un suivi tous les 10 ans semble suffisant (CHEYLAN, com. pers.). © V. FIERS. |
Le choix d’une méthode conditionne la fréquence des relevés. La fréquence est déterminante dans la compréhension des phénomènes régissant l’évolution de la dynamique des populations ou des habitats. De la fréquence des observations dépend l’interprétation des données :
- fluctuations interannuelles de population (sur un même habitat),
- fluctuations saisonnières,
- fluctuations de population en relation avec l’évolution du milieu.
On distinguera alors :
- la fréquence de chaque prélèvement au cours d’une année (liée à la méthode),
- la fréquence pluriannuelle ou encore pas de temps entre deux campagnes de suivi, qui va dépendre de l’objectif poursuivi.
La fréquence des observations est aussi fonction de l’intérêt de l’espace naturel pour le groupe étudié et de la présence ou non d’espèces remarquables à surveiller. Pour atteindre de nombreux objectifs, un suivi annuel est suffisant.
Une fréquence adaptée à la vitesse d’évolution de l’objet étudié
Le pas de temps entre deux années de comptage dépend de l’objet étudié et de sa durée de vie ou vitesse d’évolution. Pour les espèces animales ce pas de temps est variable selon la biologie (notamment de la reproduction) mais aussi la durée de vie de l’espèce (ou du groupe d’espèces) considérée.
Pour les oiseaux ou encore la flore, il aura lieu tous les 1 à 5 ans, voire davantage selon les objectifs visés. Pour les insectes le pas de temps est annuel avec, durant la période préconisée, une fréquence de mesure élevée correspondant généralement à la semaine. Ceci est lié au cycle de vie et à la vitesse d’évolution des individus. Pour un habitat, plus il se modifie et évolue rapidement, plus l’intervalle entre deux campagnes de suivi sera courte. Les données climatiques évoluent rapidement. Il faudra donc les relever avec une fréquence quasi journalière (voir Figure n°35). La pose d’une station météo permet de recueillir un grand nombre de données sans se déplacer.
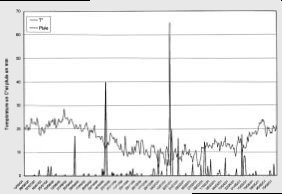 |
Figure n°35 : Évolution de la pluviométrie et de la température moyenne journalière du 19/06/00 au 19/06/01 dans la RN de Roque-Haute. Source : Rapport d’activité 2001, AGRN-RH. |
Pour ne pas faire courir des risques aux espèces
La fréquence du recueil des données au cours d’une même campagne de relevé peut être liée au risque que la méthode fait courir aux individus.
| Il faudra éviter les prélèvements trop fréquents qui destructurent les populations. L’utilisation de captures par piégeage nécessite une visite régulière des pièges pour éviter la mortalité (oiseaux dans les filets, mammifères dans les cages, amphibiens et reptiles dans les seaux …) et la dégradation du matériel biologique pour la détermination (les invertébrés dans le liquide des pots-pièges …). La récolte des insectes dans les pièges colorés se fait généralement deux fois par semaine. En ce qui concerne le baguage des oiseaux, le temps séparant deux visites au même filet ne devra pas excéder 1h15. Une fréquence de 45 min convient à la plupart des situations, mais ce laps de temps sera adapté en fonction des conditions climatiques, du risque de prédation, de la richesse en oiseaux… Pour l’inventaire des micromammifères, les pièges doivent être posés durant la nuit et inspectés tôt le matin, voire aussi après le coucher du soleil pour réduire le nombre de victimes (DAVIS, 1982). |
 |
| Photo n°33 : Dans le réseau des réserves naturelles, le suivi de la dynamique de la végétation des forêts alluviales est réalisé avec un pas de temps de 10 ans. RN de l’Ile de St Pryvé-St Mesmin. © M. CHANTEREAU |
Pour détecter des phénomènes épisodiques
Si le suivi est mis en place pour détecter certains évènements, comme une pollution dans une rivière par exemple, une courte fréquence est alors nécessaire. La fréquence des suivis pour détecter de tels changements de concentration de polluants dans l’eau dépendra du débit du courant de la rivière mais sera nécessairement quotidienne voire d’heure en heure (USHER, 1991). En dessous d’une certaine fréquence, il sera impossible de relier à un pic de pollution la disparition de certaines espèces ou la réduction de la densité de population d’autres. Pour détecter un tel incident, le temps entre deux relevés (temps entre deux collections successives de données) ne doit pas être inférieur à la moitié du temps durant lequel les effets de l’incident peuvent être perçus (DAVIS, 1982). La figure n°36 nous montre une chute de nitrates qui a lieu durant un été. Pour détecter une telle évolution, les relevés doivent être, au minimum, mensuels.
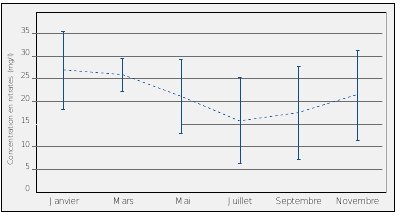 |
| Figure n°36 : Evolution de la concentration en Nitrates (en mg/L) de 10 rivières de la Somme (Agence de l'Eau Artois-Picardie, 1995) entre janvier et novembre 1995. Source : Extrait de FAGOT (2000). |
1.3.7.7. Prévoir la durée de l’étude
Pour tout suivi mis en place, il est important de considérer les problèmes d’échelle de temps.
Intégrer les fluctuations annuelles
 |
| Figure n°37 : Courbes de fluctuation de populations de papillons dans la RN de l’Ile de la Platière. B. PONT, com. pers. |
La durée et la fréquence des suivis scientifiques doit intégrer le fait que les populations, plus particulièrement d’insectes, sont fluctuantes d’une année sur l’autre (voir Figure n°37). Il est donc nécessaire d’opérer sur un pas de temps suffisant pour être en mesure d’obtenir des données interprétables.
Une étude doit être suffisamment longue pour que plusieurs cycles des processus qui entrent en jeu (période de nidification par exemple) soient inclus. Pour les insectes, il est important de prendre en compte leur cycle d’apparition (cas des hannetons qui ne sortent massivement que tous les quatre ans par exemple). Aussi, réaliser des inventaires sur plusieurs années est important pour prétendre à l’exhaustivité. Selon DOMMANGET (com. pers.), deux à trois années consécutives sont nécessaires avant de prétendre avoir une liste quasi complète des Odonates sur un site. Ceci est valable aussi pour les autres insectes (Lépidoptères…). Il est aussi probable que les espèces végétales d’un site ne pourront toutes être détectées en une seule année d’inventaire du fait d’une phénologie très étalée dans le temps nécessitant de nombreuses visites.
Intégrer les éléments extérieurs
 |
| Photo n°34 : Azuré de la Sanguisorbe dans la RN du Marais de Lavours. © Photo : F. DARINOT / EID. |
Outre les fluctuations annuelles de populations, des phénomènes extérieurs peuvent avoir une incidence sur les résultats. La durée doit permettre au gestionnaire d’observer des phénomènes qui peuvent être importants pour le milieu (baisse des niveaux d’eau par exemple). Une étude doit être suffisamment longue pour qu’elle ne prenne pas en compte que des phénomènes transitoires : inondations, pics de pollution ou fluctuations interannuelles de population en fonction des aléas climatiques…
Dans le cas de suivi des actions de gestion, la durée doit cependant être suffisamment courte pour ne pas intégrer les changements liés à l’évolution naturelle du milieu.